



丸山さん(患者):「先生、最近リハビリを頑張っても、あまり良くなってる気がしなくて…。正直、やる気が出ないんです。」
金子先生(医師):「丸山さん、その気持ちはとてもよく分かります。脳卒中のリハビリは、体だけでなく“心”のリハビリでもあるんですよ。」
丸山さん:「心のリハビリ…ですか?」
金子先生:「ええ。リハビリを続けるには、モチベーションを保つことが大切です。効果を実感できなくても、昨日より“少しでもできたこと”を見つけてみてください。」
丸山さん:「たとえば?」
金子先生:「“今日は3歩多く歩けた”“ボタンを自分で留められた”——そんな小さな達成が大切です。それを積み重ねると、確実に前へ進んでいます。」
丸山さん:「たしかに、そう考えると少し気が楽になります。」
金子先生:「ご家族と一緒に喜びを共有するのもいいですよ。認めてもらったり、褒めてもらったりすることで、回復の過程を実感できます。最近は音楽やゲームを使ったリハビリも増えていて、楽しみながら取り組む方法もあるんですよ。」
丸山さん:「楽しみながら…それなら続けられそうですね。」
金子先生:「焦らず、一歩ずつです。モチベーションは環境と支えで育ちます。小さな成功を見逃さずに、前に進みましょう。」
リハビリの“やる気”が続かないとき
脳卒中の回復には、どうしても長い時間と努力が必要です。
最初は「頑張ろう」と思っていても、日が経つにつれて「なかなか効果が感じられない」「疲れてやる気が出ない」と感じる方は少なくありません。
そんなとき大切なのは、「心のリハビリ」を意識すること。モチベーション(やる気)を保つことも、回復の大切な一歩です。

モチベーションが下がる理由
リハビリの途中で意欲が落ちてしまうのには、いくつかの理由があります。
● 効果がすぐに実感できない
● 疲労や痛みが続く
● 不安や落ち込みが強くなる
● 目標が漠然としていて先が見えない
● 周囲の理解や支えが少ない
実際の研究では、「周囲からの支援が多い人ほど、リハビリのやる気や生活の質(QOL)が高い」ことが報告されています【Lee et al., Int J Environ Res Public Health, 2022】。
つまり、“支え合う環境”がモチベーションを支える鍵なのです。
やる気を保つ3つのコツ
(1) 小さな目標を立てよう
「今日は3歩だけでも歩く」「自分で上着を着る」など、小さなゴールを決めてみましょう。
少しずつ達成していくことで「できた!」という自信が積み重なり、気持ちが前向きになります。
(2) フィードバックと褒め言葉を大切に
リハビリで少しでも動きが良くなったときは、言葉で伝える・記録で見える化するのがポイントです。
「昨日より手が上がったね」「前より歩くのがスムーズだよ」そんな一言が、大きな励みになります。
医療スタッフや家族のポジティブな声かけが、リハビリ意欲を高めることが知られています。
(3) “楽しい”を取り入れる
音楽を聴きながらの体操や、ゲーム感覚でできるリハビリ、VR(仮想現実)を使った練習など、楽しさを感じられる工夫が効果的です。
研究でも、「楽しさのあるリハビリは意欲を保ちやすい」と報告されています【Nguyen et al., Front Neurol, 2024】。


家族ができるサポート
リハビリを支えるのは、医療者だけではありません。
家族の関わり方も、患者さんの気持ちに大きな影響を与えます。
● 小さな変化を一緒に喜ぶ:「昨日より元気そうだね」と伝えるだけでも十分です。
● 無理をさせず、できたことを褒める:ペースは人それぞれ。焦らせないことが大切です。
● 安心してリハビリできる環境を整える:転倒の心配がない場所、明るい雰囲気づくりなど。
過度な励ましよりも、「一緒に頑張ろう」という寄り添いの気持ちが、長く続ける力になります。

まとめ
リハビリのモチベーションは、環境・支援・成功体験の3つで育ちます。焦らず、昨日より少しできたことを積み重ねる。その積み重ねが、確実に回復へとつながっていきます。
“心のリハビリ”を忘れずに、今日も一歩ずつ進んでいきましょう。
引用文献
脳卒中の予防やリスクについてもっと詳しく知りたい方へ!
患者様やそのご家族には特におすすめ!!
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。


STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓

パーキンソン病と“腸-脳軸”の最新研究に迫る
1. パーキンソン病と「腸」の意外な関係
パーキンソン病というと、手のふるえや動作の鈍さなど、「脳の病気」という印象が強いかもしれません。しかし、実は発症のはるか前から、便秘や腸の不調が先に起こっていることが知られています。
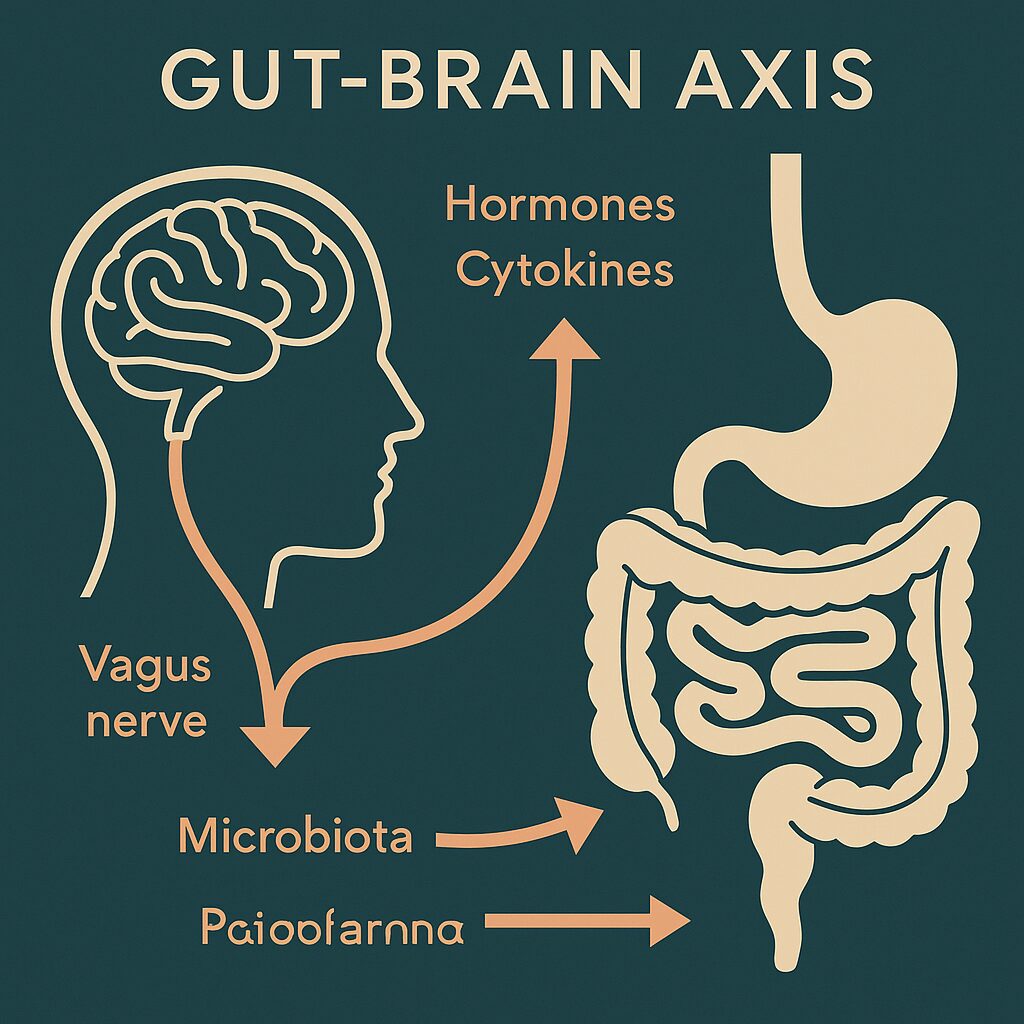
このことから注目されているのが、「腸-脳軸(gut-brain axis)」という考え方です。腸と脳が神経や免疫、ホルモンを通じて双方向に情報をやりとりしているという仕組みで、近年の研究では、腸内環境の異常がパーキンソン病の発症に関与している可能性が指摘されています。
2. 「腸-脳軸」とは?:腸は“第二の脳”だった
私たちの腸には、腸内細菌(腸内フローラ)が数百〜数千種類も棲んでおり、そのバランスが健康に深く関わっています。さらに、腸には1000億個以上の神経細胞があり、**脳とほぼ独立して働く神経系(腸管神経系)**が存在します。
この腸と脳の間をつなぐ“通信回線”が「腸-脳軸」で、以下の3つを通じて情報がやり取りされます:
・迷走神経(神経伝達)
・サイトカイン(免疫物質)
・ホルモン類(内分泌系)
この仕組みが破綻すると、腸内の炎症やバリア機能低下が神経変性疾患に波及する可能性があると考えられています。
3. パーキンソン病発症の起点は腸?
近年の研究では、パーキンソン病患者の腸内環境の乱れ(ディスバイオーシス)が報告されています。さらに、注目されているのが「αシヌクレイン」という異常タンパク質です。
・健常な脳でも存在するこのタンパク質が、異常に凝集・蓄積して神経細胞死を引き起こすことが知られています。
・Braak仮説(2003)によると、αシヌクレインの蓄積は腸の神経叢から始まり、迷走神経を通って脳に広がる可能性があるとされています。
この仮説を裏付けるように、動物実験でも、腸に異常αシヌクレインを導入すると、後に脳にも同じ変性が波及することが示されました。
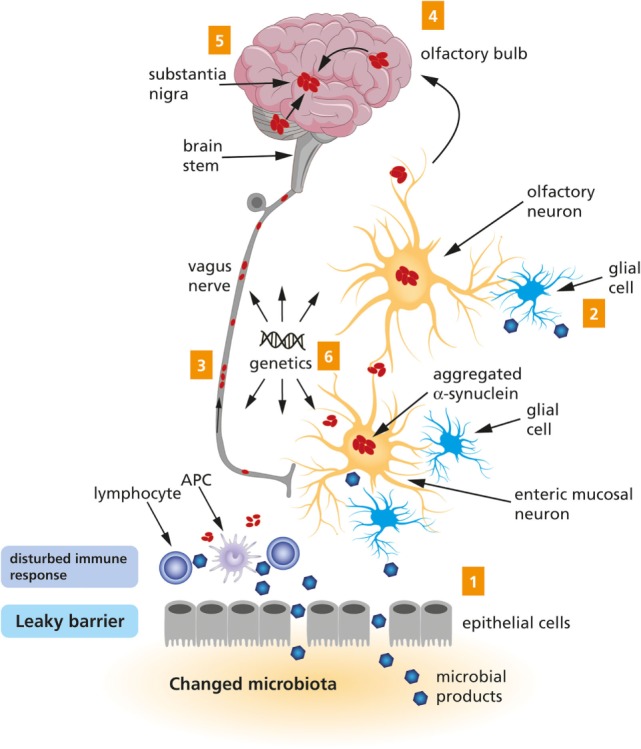
図:下記文献より引用(Braak, H. et al. 2003)
4. 腸内環境を整えることで予防できるのか?
完全に解明されたわけではありませんが、いくつかの研究では腸内細菌叢の改善がパーキンソン病の症状軽減に寄与する可能性が報告されています。
✔️注目されている介入方法
・プロバイオティクス(善玉菌)摂取
・プレバイオティクス(腸内細菌のエサとなる食物繊維)
・地中海式食事(多様な植物性食品)
・便移植(FMT)の試験的実施(臨床研究段階)
ただし、これらは補助的アプローチであり、治療法ではない点に注意が必要です。
5. 今後の研究など
腸-脳軸と神経疾患の関係は、まだ発展途上の分野です。しかし、パーキンソン病に関しては以下のような方向で研究が進んでいます。
・バイオマーカーとしての腸内細菌
→ 発症前からの変化を捉え、早期診断に応用
・治療対象としての腸
→ 腸内炎症を抑えることで脳の変性進行を遅らせる可能性
・個別化医療
→ 腸内フローラに応じた食事・薬のカスタマイズ
6. まとめ:腸に注目する新しいパーキンソン病対策
パーキンソン病は脳だけを見る時代から、全身、特に腸の状態を見る時代へと変わりつつあります。
「便秘が長く続いている」「腸の調子がいつも悪い」――こうしたサインが、もしかしたら神経の変化のはじまりかもしれません。腸内環境に目を向けることは、パーキンソン病の予防や早期発見につながる可能性があるのです。
7. 引用・参考文献
・Braak, H., et al. (2003). Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiology of Aging.
・Sampson, T. R., et al. (2016). Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease. Cell.
・Bedarf, J. R., et al. (2017). Functional implications of microbial and viral gut metagenome changes in early stage L-DOPA-naïve Parkinson’s disease patients. Genome Medicine.
・Heintz-Buschart, A., et al. (2018). The nasal and gut microbiome in Parkinson’s disease and idiopathic rapid eye movement sleep behavior disorder. Movement Disorders.
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。



STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓

1. パーキンソン病と“早期発見”の重要性
手のふるえ、動作の遅れ、歩きにくさ――。こうした変化が「年のせい」と見過ごされてしまうことは少なくありません。ですが、それがパーキンソン病の始まりだったと後から気づくケースも多く報告されています。
パーキンソン病は、脳内のドーパミン神経が徐々に減少していく進行性の神経疾患です。発症初期は日常生活に支障がないことも多いため、診断が遅れがちです。しかし、早い段階で治療を始めることで、進行を緩やかにし、生活の質(QOL)を長く保つことができるとわかってきました。
そのため、今、世界中で注目されているのが「早期発見」を助ける技術の開発です。中でも、近年発表された“スマートペン”による簡単な筆記テストは、たった数分の動作でパーキンソン病を高精度で検出できる可能性があるとして、大きな注目を集めています。
このペンは、将来的に家庭でも使えるようになるかもしれません。

2. スマートペンとは?—カリフォルニア大学が開発した革新的ツール—
パーキンソン病の診断は、これまで医師による問診や動作観察、MRIやDATスキャンなどの画像検査が中心でした。しかし近年、アメリカ・カリフォルニア大学ロサンゼルス校(UCLA)の研究チームが発表した「スマートペン」は、紙に文字を書くという日常的な動作だけで、パーキンソン病の兆候を検出できる革新的なツールです。
このスマートペンは、見た目こそ普通のボールペンのようですが、内部に微細な磁気センサーと特別なインクが組み込まれています。これにより、書いている間に発生する微小な手の動きのブレやリズムの乱れを高感度に検出。さらに、それらのデータをAIが解析し、健康な人とパーキンソン病の患者を96.2%の精度で識別できると報告されています。
ペン断面図
・内部に磁気センサーとBluetooth送信機
・ペン先に磁性インクが通っている様子
筆記中の様子
・ユーザーが紙に文字を書く
・磁場の変化がペン先とセンサーで検出される
AIによる解析画面(スマホ or タブレット)
・軌跡データが波形化 or 数値化され、診断レポート表示
図:文献より引用
3. どうやって検出するの?筆記動作と電気信号の関係
私たちが紙に文字を書くとき、無意識のうちに手の筋肉や関節を繊細にコントロールしています。ところが、パーキンソン病になると、こうした「細かい動きのなめらかさ」が失われ、筆記中に小刻みなふるえやリズムの乱れが現れることがあります。
UCLAの研究チームが開発したスマートペンは、こうした微細な運動の変化を“磁場の揺らぎ”として検出します。ペン先から出る磁性インクが紙上で動くことで、ペン内部の磁気センサーがわずかな動きのズレをリアルタイムで読み取るのです。
取得されたデータはBluetoothなどでタブレットやPCに送られ、AI(人工知能)が数万件の正常・異常な書字データと比較して自動解析します。その結果、ほんの数行の文字を書くことで、症状の有無を高精度で判断できる仕組みになっています。
検出対象:手のふるえ(振戦)、筆圧の変化、動作リズムの乱れ
センシング方法:磁場の変化を電気信号に変換
AI解析内容:波形パターン認識(例:文字の揺れ方や速度)
所要時間:わずか1~2分で完了

4. 診断精度96.2%の秘密:研究データとAI活用の実態
このスマートペンの最も注目すべき点は、96.2%という非常に高い識別精度を実現している点です。これは、従来の運動機能テストや問診による初期診断よりも、はるかに高い信頼性を示しています。
UCLAの研究チームは、患者3名と健常者13名を対象に、書字と空中動作を含む動作データを収集。ペンが取得したデータは電気信号として約3万個以上の特徴量に分解され、AIが「ふるえの大きさ」や「運筆のブレ」などを解析しました。
AIには、パーキンソン病の有無だけでなく、その進行度の傾向までも評価できるポテンシャルがあり、今後の研究次第でさらなる高精度化も期待されています。
5. 今後の展望:自宅診断や医療現場での活用可能性
将来的には、このスマートペンが病院だけでなく自宅で使える診断補助ツールとして普及する可能性があります。
現在、病院でのパーキンソン病診断には予約や検査の待機時間が発生し、特に地方では医師不足の課題もあります。しかし、このペンを活用すれば:
家庭内で短時間のセルフチェックが可能
医師がリモートで結果を確認 → 遠隔医療の実現
定期的な筆記チェックで進行具合を見守れる → 経過観察ツールにも
また、スマートペン技術は他の神経疾患(例:本態性振戦、多系統萎縮症など)への応用も期待されています。

パーキンソン病の早期発見は、生活の質を保ち、本人や家族の不安を和らげる大切な第一歩です。
UCLAが開発したスマートペンは、「誰でも・簡単に・高精度で」チェックできるという点で、従来の医療診断のハードルを一気に下げる可能性を持っています。今後の研究や社会実装の進展次第で、「家庭での予防医療」という新しいスタンダードが生まれるかもしれません。
7. 引用文献
Zhang, H., Li, Y., Chen, J., et al. (2025). Diagnosing Parkinson’s disease using a soft magnetoelastic smart pen. Nature Chemical Engineering, published June 2, 2025.
https://www.nature.com/articles/s44286-025-00228-4
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。



STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓

登場人物:
・丸山さん(患者・脳卒中後在宅療養中) ・金子先生(医師)

丸山さん:「先生、最近、朝ちょっとフラッとするんです。血圧のせいですかね?」
金子先生:「そうですね。脳卒中の再発予防には、血圧のコントロールがとても大切です。ご自宅で血圧、測っていますか?」
丸山さん:「いや、病院で測れば足りるかと思って…」
金子先生:「実は、家庭で測った血圧のほうが本来の値に近いんです。朝と夜、決まった時間に測ると、体の状態がよく分かりますよ。」
丸山さん:「そうなんですか。でも血圧計って難しそうで…」
金子先生:「最近の血圧計はボタンひとつで測れるものも多く、表示も見やすくなっています。腕にカフを巻く“上腕式”が、精度も安定していておすすめです。」
丸山さん:「なるほど。測ったあとはどうすれば?」
金子先生:「記録が大事です。毎回、日付と時間、測定値を書いておくだけでOK。あとでお薬の調整にも役立ちます。」
丸山さん:「朝は何時くらいに測るといいですか?」
金子先生:「起きて1時間以内、朝食や薬の前が基本です。夜は寝る前にリラックスした状態で。できれば毎日、同じタイミングで測ってください。」
丸山さん:「わかりました。“日課”にしちゃえばいいんですね。」
金子先生:「そうです。血圧は、毎日コツコツ測ることで“変化の兆し”が見えてくるんですよ。」
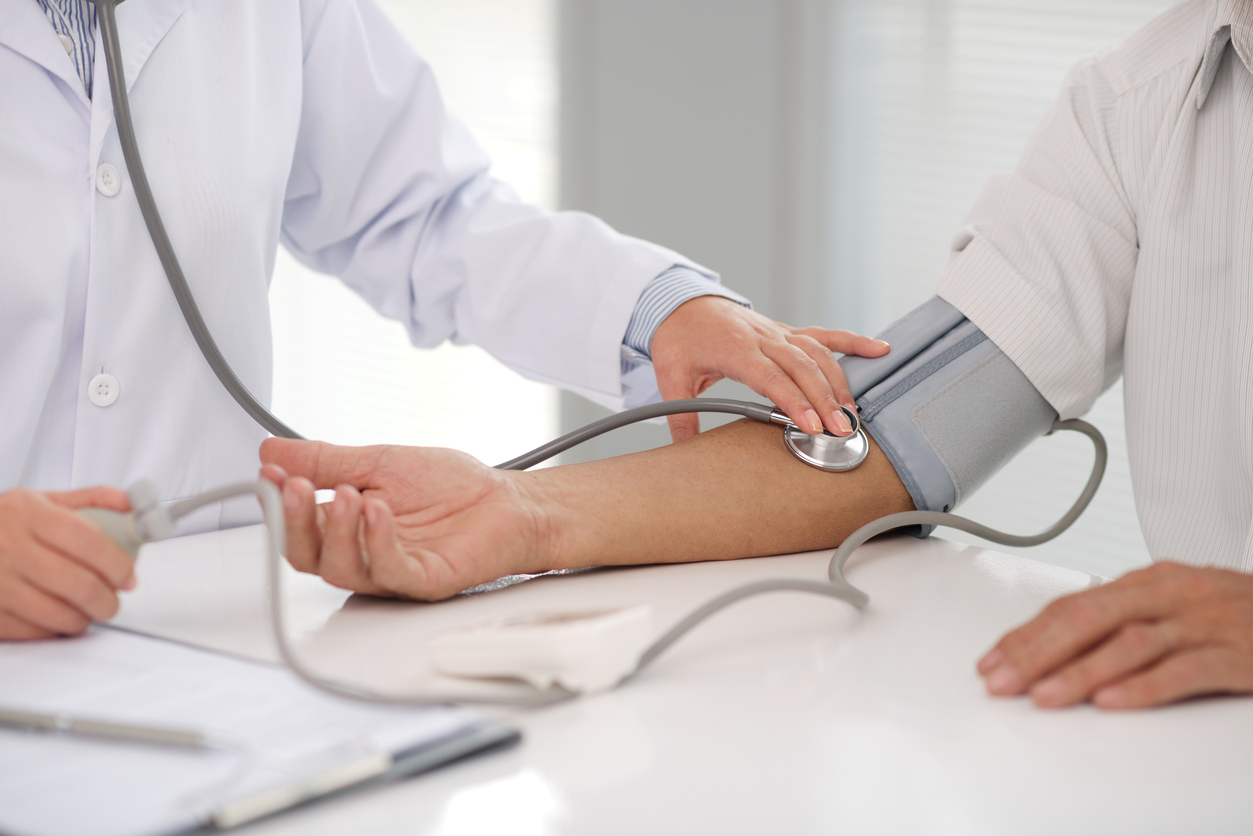
1. なぜ家庭で血圧を測るのか?
高血圧は自覚症状がないまま進行し、脳卒中や心筋梗塞などの重大な疾患を引き起こす可能性があります。家庭での定期的な血圧測定は、これらの疾患の予防や早期発見に役立ちます。
また、家庭での血圧測定は、医療機関での測定よりも日常の状態を反映しやすく、医師の診断や治療方針の決定に有用です。
2. 血圧測定の適切なタイミング
血圧は一日の中で変動するため、毎日同じ時間に測定することが重要です。
朝の測定: 起床後1時間以内、トイレを済ませ、朝食や薬を摂取する前に、椅子に座り5分以上安静にしてから測定しましょう。
夜の測定: 就寝前に、椅子に座り5分以上安静にしてから測定します。
これらのタイミングでの測定は、早朝高血圧や夜間高血圧の発見にもつながります。
3. 血圧計の選び方とおすすめ機種
家庭用血圧計は主に「上腕式」と「手首式」があります。
上腕式: 腕にカフを巻いて測定するタイプで、一般的に精度が高く、医療機関でも使用されています。
手首式: 手首で測定するタイプで、コンパクトで持ち運びに便利ですが、測定姿勢に注意が必要です。

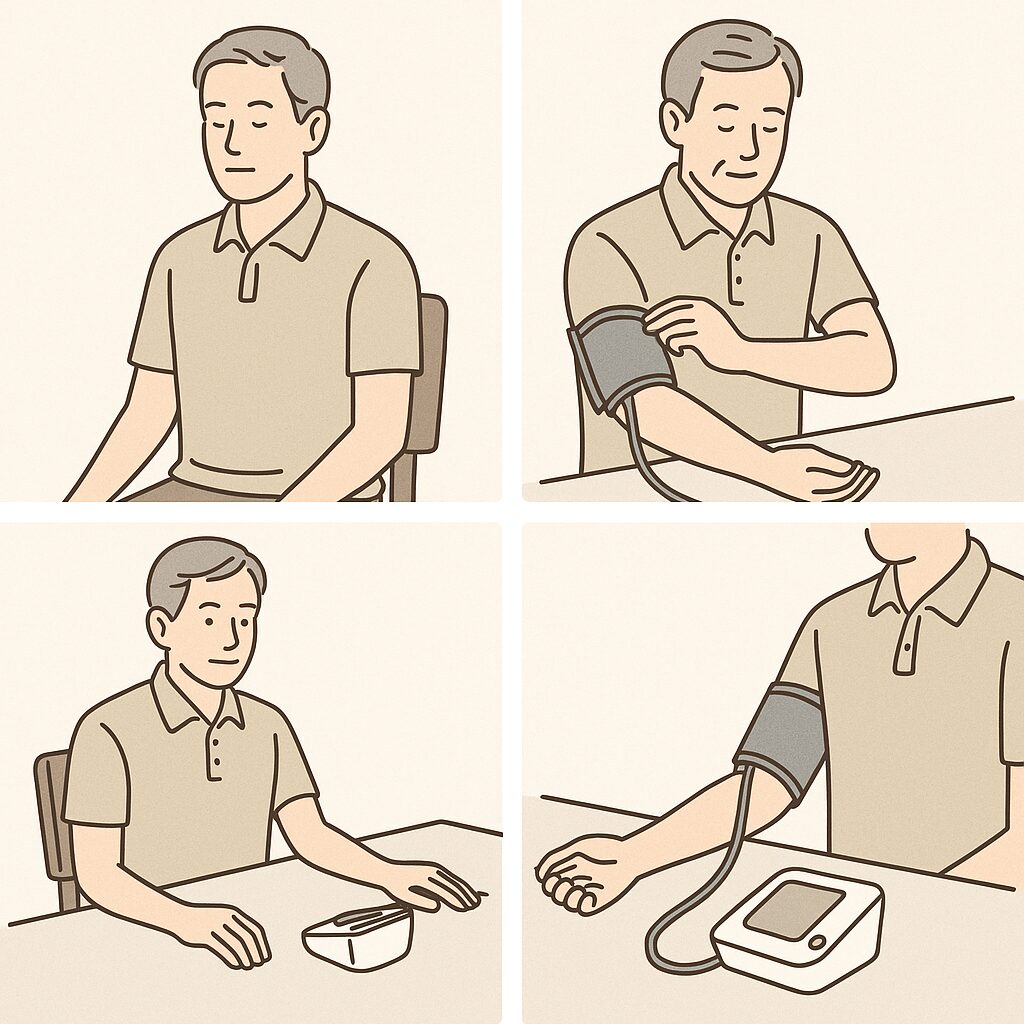
4. 正しい血圧の測り方
正確な血圧測定のためには、以下のポイントを守りましょう。
①リラックス: 測定前に5分以上安静にし、深呼吸をしてリラックスします。
②姿勢: 背もたれのある椅子に座り、足を組まず、腕を心臓の高さに保ちます。
③測定回数: 1回の測定だけでなく、2回測定して平均値を取るとより正確です。
これらの方法は、血圧の変動を最小限に抑え、正確な測定につながります。
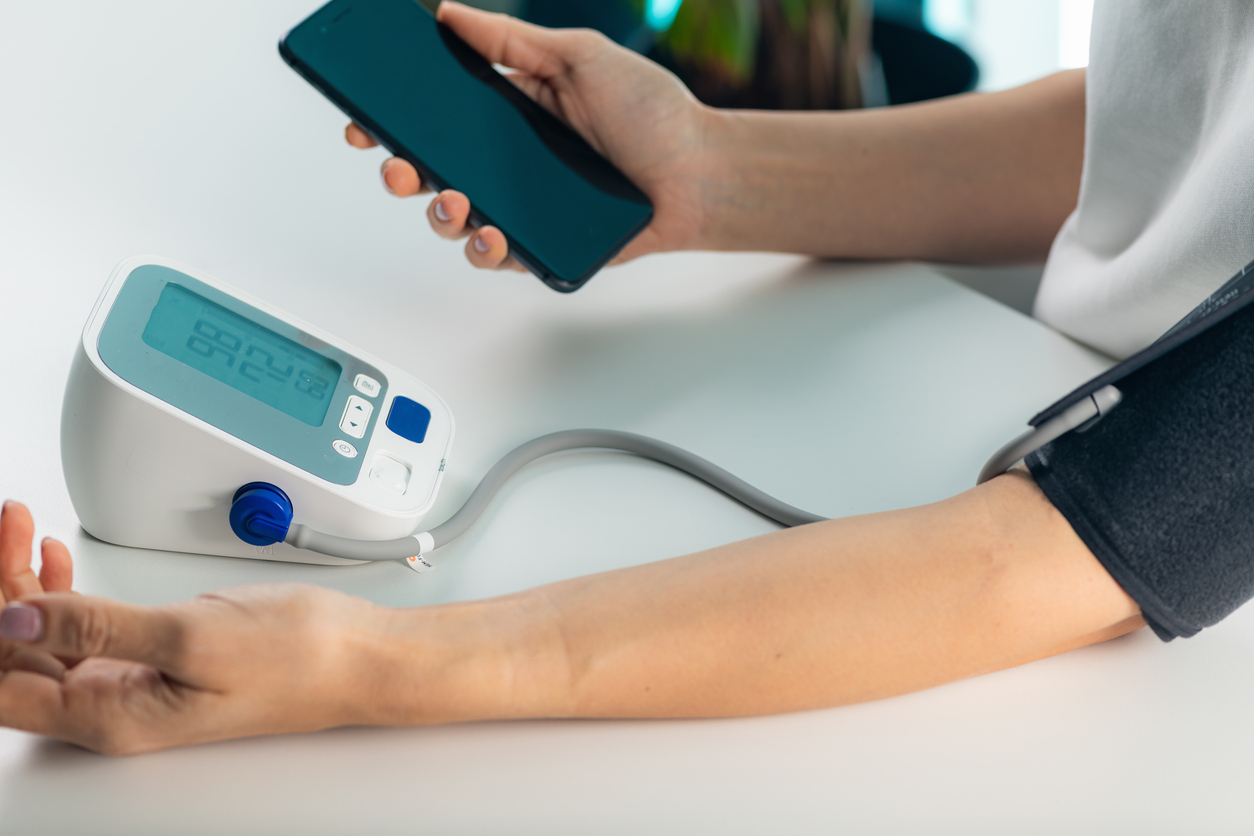
5. 測定結果の記録と医師への報告
測定した血圧値は、日付や時間とともに記録し、定期的に医師に報告しましょう。スマートフォンのアプリや血圧手帳を活用すると、管理が容易になります。
記録を継続することで、血圧の傾向や変動を把握でき、治療や生活習慣の改善に役立ちます。
6. よくある質問Q&A
Q1. 測定値が毎回異なるのはなぜ?
A. 血圧は一日の中で変動します。測定条件を一定にし、毎日同じ時間に測定することで、正確な傾向を把握できます。
Q2. 手首式血圧計は正確ですか?
A. 手首式は便利ですが、測定姿勢に注意が必要です。正確な測定には、上腕式をおすすめします。
Q3. 血圧が低すぎると問題ですか?
A. 低血圧も症状がある場合は注意が必要です。めまいや立ちくらみが頻繁に起こる場合は、医師に相談しましょう。
7. まとめ:毎日の血圧測定が健康を守る
家庭での血圧測定は、健康管理の基本です。特に脳卒中や心疾患の予防には、日々の血圧管理が欠かせません。正しい方法で測定し、記録を続けることで、健康な生活を維持しましょう。
8. 参考
・日本高血圧学会「家庭で血圧を測定しましょう」
https://www.jpnsh.jp/pub_katei.html
・厚生労働省 e-ヘルスネット「高血圧」
https://www.e-healthnet.mhlw.go.jp/information/dictionary/metabolic/ym-002.html
・オムロン ヘルスケア:血圧測定の正しいタイミングと測り方
https://www.faq.healthcare.omron.co.jp/faq/show/4218?category_id=872&site_domain=jp
・シチズンシステムズ「正しい血圧の測り方」
https://www.citizen-systems.co.jp/health/column/article/article_15.html
・公益社団法人 日本脳卒中協会「脳卒中予防十か条」
https://www.jsa-web.jp/modules/brain_info/index.php?content_id=6
脳卒中の予防やリスクについてもっと詳しく知りたい方へ!
患者様やそのご家族には特におすすめ!!
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。


STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓

Facebook メルマガ登録にて定期的に最新情報を受け取れます。
脳卒中は、日本において要介護の主な原因の一つであり、早期対応と継続的なリハビリが非常に重要です。2018年に施行された「循環器病対策基本法」は、脳卒中を含む循環器病患者への支援体制を整備し、医療・介護サービスが切れ目なく提供される仕組みを推進しています。
この法律に基づき、多くの地域で活用されているのが「地域連携パス」という仕組みです。本記事では、地域連携パスを活用することで受けられる支援や、その利用方法について詳しく解説します。
地域連携パスとは、脳卒中などの患者が急性期病院から回復期リハビリ病院、そして在宅医療や介護サービスに至るまで、一貫した医療・介護サービスを受けられるようにする仕組みです。
患者の治療・リハビリの進行状況や必要なケアを記録した共通の計画書が使用され、関係する医療機関や介護施設が情報を共有することで、途切れのない支援が可能になります。

地域連携パスを活用することで、以下のような支援が受けられます。
①急性期から回復期へのスムーズな移行
● 急性期病院での治療が終わった後、患者の状態に応じてリハビリテーションを専門とする病院や施設に移ります。
● 地域連携パスにより、診療情報が円滑に引き継がれます。
②リハビリ計画の一元管理
● 患者の目標(例:歩行の回復、自宅での生活再開)を基に、各機関が一貫して治療やリハビリを提供します。
● 定期的にパスを更新することで、進捗を確認しつつ適切なケアを継続します。
③在宅医療や介護サービスとの連携
● 自宅に戻った後も、訪問リハビリや介護サービスを受けられるよう支援。
● 医療機関、訪問看護ステーション、地域包括支援センターが連携し、患者とその家族をサポートします。

①主治医に相談する
脳卒中で入院中の患者さんが地域連携パスを利用するには、まず主治医や病院の医療相談員に相談します。病院が地域連携パスの利用手続きを進めてくれます。
②退院後のリハビリ先を決定
退院後のリハビリをどこで行うか、主治医と相談して決定します。多くの場合、リハビリ専門の病院や在宅リハビリサービスが候補となります。
※退院後必ずしもリハビリテーションを行わなければならないというわけではありません。
③地域の連携機関との調整
病院やリハビリ施設、訪問看護ステーションなど、患者の状態に応じた支援機関が調整を行います。パスを使うことで、患者が自分で手続きする手間が大幅に軽減されます。

①急性期病院での診断と治療
発症直後は、急性期病院での治療(t-PA療法や手術、点滴治療など)が行われます。
②地域連携パスの作成
病院の医師や相談員が、患者の状態や治療計画を地域連携パスに記載します。
③回復期リハビリ病院での治療
退院後、リハビリ専門の施設で身体機能の回復を目指します。

● 自宅での生活を目指す場合は、訪問看護や訪問リハビリを利用。
● 必要に応じてデイケアや介護施設を利用する選択肢もあります。

脳卒中を患った後、適切な治療やリハビリを受けるためには、急性期から在宅復帰までの一貫した支援が重要です。地域連携パスを活用することで、患者と家族は安心して回復を目指すことができます。
もし脳卒中の経験がある方、またはご家族が心配な場合は、主治医や地域の医療機関に相談し、地域連携パスの利用を検討してみてください。
● 日本脳卒中協会
患者様やそのご家族には特におすすめ!!
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。


STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓

Facebook メルマガ登録にて定期的に最新情報を受け取れます。
2018年に施行された循環器病対策基本法は、脳卒中や心臓病といった循環器病に対する予防や早期対応、患者支援を全国規模で推進する法律です。この法律に基づき、国や地方自治体、医療機関が一体となって、循環器病による死亡や後遺症を減らすための取り組みが行われています。
特に脳卒中は、早期発見・早期治療が後遺症を軽減するために極めて重要です。この記事では、脳卒中の初期症状をいち早く見抜くための合言葉「FAST」について詳しく解説します。いざというときの知識としてぜひ覚えておいてください。
脳卒中は、時間との勝負と言われる病気です。発症後に適切な治療を早く受けることで、後遺症を軽減し、命を救える可能性が飛躍的に高まります。
ゴールデンタイムは発症後4.5時間!
脳梗塞の治療法である「t-PA(血栓溶解療法)」は、発症後4.5時間以内に行う必要があります。また、脳出血やくも膜下出血の場合も、早期の診断と手術が後遺症のリスクを大幅に下げます。
したがって、初期症状に気づき、迅速に行動することが家族や周囲の命を守る第一歩です。

「FAST」は、脳卒中の初期症状を簡単に覚えるための英語の合言葉です。この4つの文字に、それぞれ重要なポイントが含まれています。

F:Face(顔)
顔の片側がゆがむ、笑顔が左右非対称になるなどの症状が見られる場合、脳卒中の可能性があります。
チェック方法:笑顔を作ってもらい、左右の口角が同じ高さに上がるか確認しましょう。
A:Arms(腕)
腕に力が入らない、一方の腕が下がるなどの症状が現れることがあります。
チェック方法:両腕を水平に上げてもらい、片方が落ちてこないか確認してください。
S:Speech(言葉)
言葉がはっきりしない、ろれつが回らない、言葉が出てこないなどの異常があります。
チェック方法:簡単な言葉を繰り返してもらい、正常に発音できるか確認しましょう。
T:Time(時間)
症状が見られたら一刻も早く医療機関へ。発症時刻を確認し、救急車を呼びましょう。
これら4つのポイントを素早く確認することで、脳卒中の可能性を高い確率で察知できます。
1. 迷わず119番通報 脳卒中の症状が見られたら、すぐに救急車を呼びましょう。発症時刻を正確に伝えることが治療のカギになります。
2. 安静にする 無理に動かさず、平らな場所に寝かせて安静を保たせます。吐き気がある場合は横向きに寝かせましょう。
3. 頭を冷やさない 頭を冷やしても症状が改善することはありません。むしろ適切な医療機関への搬送が優先です。
4. 可能であれば症状を記録 症状の始まりや進行をメモしておくと、医師が迅速に診断を行う助けになります。

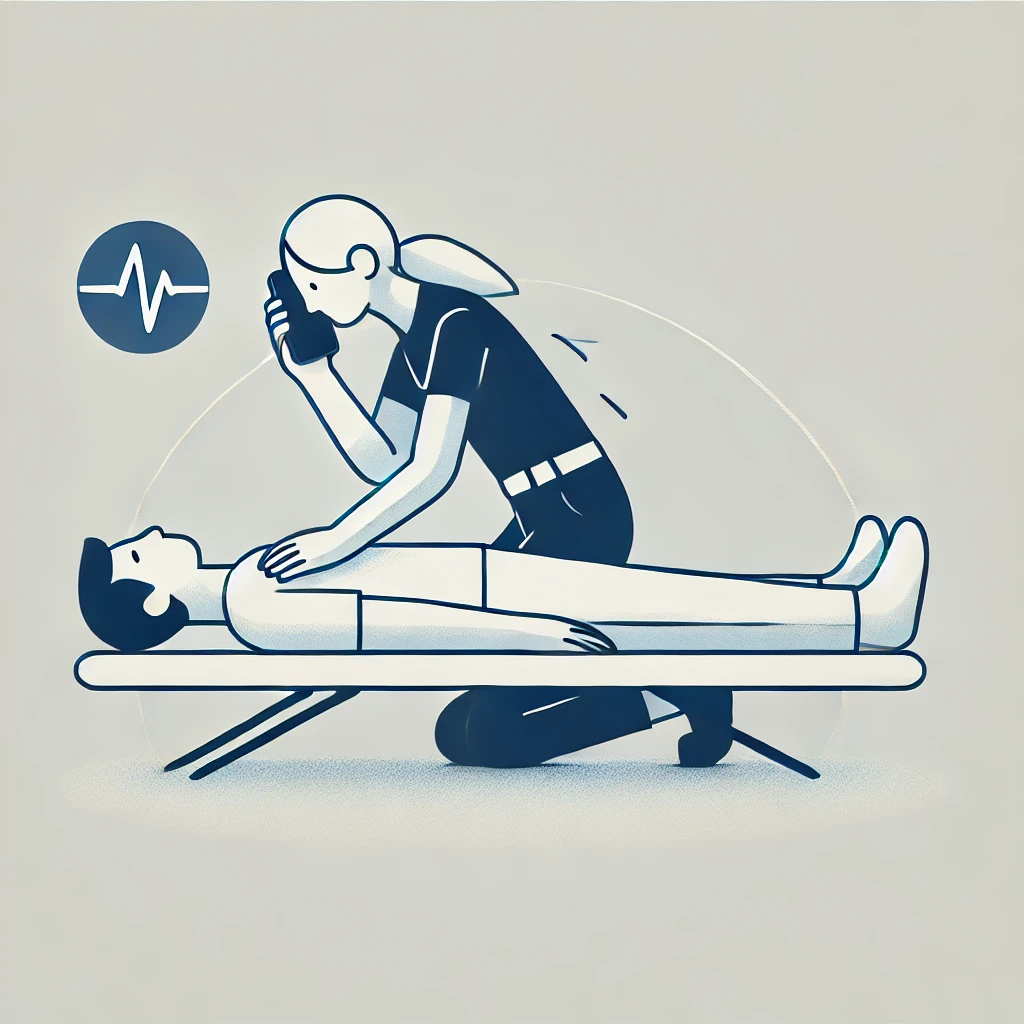
一度脳卒中を発症した方は、再発予防が極めて重要です。以下のポイントを参考にしましょう。
血圧管理:家庭での血圧測定を習慣にしましょう。
生活習慣の改善:減塩食や適度な運動を取り入れ、禁煙・適量飲酒を心がけます。
定期検診:医療機関での経過観察を続け、異常があれば早期に対応しましょう。
「FAST」の合言葉を覚えることは、脳卒中の初期対応において非常に大切です。初期症状をいち早く察知し、迅速に医療機関へ連絡することで、命を守り、後遺症のリスクを減らせます。
また、普段からの生活習慣の改善や健康管理が、脳卒中の予防や再発防止につながります。この機会に、自分や家族の健康について見直してみませんか?
● 日本脳卒中協会
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。


STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓

Facebook メルマガ登録にて定期的に最新情報を受け取れます。
皆さんは「循環器病対策基本法」をご存じですか?この法律は2018年に制定され、脳卒中や心臓病といった循環器病を予防し、患者さんへの医療や福祉の質を向上させることを目的としています。特に脳卒中は、日本人の死因や要介護の主な原因の一つであり、発症を防ぐための対策が国全体で進められています。
この法律に基づき、私たち一人ひとりも生活習慣を見直すことで、脳卒中のリスクを大幅に減らすことができます。今回は、脳卒中を未然に防ぐための最新予防法やチェックリストをご紹介します。

高血圧
血圧が高いと血管に負担がかかり、動脈硬化が進みやすくなります。脳の血管が細くなったり弱くなったりすることで、詰まりや破れが起こりやすくなります。
糖尿病
血糖値が高い状態が続くと、血管の壁が傷つきやすくなり、動脈硬化の進行を早めます。糖尿病を放置すると脳卒中のリスクが大きく上昇します。
心房細動
不整脈の一種である「心房細動」は、血流が乱れやすいため血栓(血のかたまり)ができやすく、それが脳に運ばれて血管を詰まらせる場合があります。
喫煙・過度の飲酒・肥満
これらの要因は血管や心臓に大きな負担をかけます。喫煙は血管を収縮させ、過度の飲酒は血圧を上昇させ、肥満は生活習慣病を引き起こすリスク要因になります。


減塩&バランスの良い食事
減塩:一日6g未満を目指すのが理想です。味噌汁は具だくさんにして、塩分を控えめにすると続けやすくなります。
タンパク質と野菜をしっかり:魚や大豆製品、肉などの良質なたんぱく質と、野菜・果物からのビタミン・ミネラルをバランスよく摂取しましょう。
適度な運動
ウォーキングやストレッチなど、継続しやすい運動を取り入れるだけでも血圧の改善や体重管理に効果的です。週に3回以上、1回30分程度の運動を目安に続けましょう。
禁煙・適度な飲酒
禁煙は脳卒中リスクを大きく下げます。医療機関での禁煙外来を活用してみるのも一つの手です。
飲酒量はできるだけ控えめにしましょう。推奨量を超える飲酒は血圧の上昇に直結します。


定期的な健康診断
●高血圧や糖尿病など、異常値が出やすい人は年に1回以上の健康診断を受けましょう。
●早期発見・早期治療が脳卒中予防には欠かせません。
血圧・血糖値のセルフモニタリング
●血圧計や血糖値測定器を自宅で活用し、日々の数値を把握することが大切です。
●数値が高い場合は生活改善とあわせて医師に相談しましょう。
最新の治療・指導を受ける
病院の外来で生活習慣病指導を受ける、もしくは専門外来での血圧・血糖値コントロールを行うと、リスクを効果的に下げられます。

☑ 血圧・血糖値を定期的に測っている
☑ 1日6g未満の減塩を心がけている
☑ 週3回以上、1回30分の運動を取り入れている
☑ 喫煙・過度の飲酒を控えている
☑ 定期的な健康診断(少なくとも年1回)を受けている
☑ 心房細動などの不整脈が疑われる場合、専門医に相談している
☑ BMI(体格指数)を適正範囲(18.5~24.9)に保つよう努めている
これらの項目で「できていない」「不安だ」というものがあれば、まずは1つずつ習慣化できるよう取り組みましょう。
脳卒中は未然に防ぐことが十分に可能な病気です。普段からの生活習慣が大きく影響するため、無理のない範囲で継続可能な対策を取り入れていくことが重要になります。少しでも気になる症状や生活習慣病のリスクがある方は、早めに医療機関で相談し、適切な治療や指導を受けましょう。
・厚生労働省:循環器病対策について
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/kenkou/jyunkanki/index.html
・日本脳卒中協会
https://www.jsa-web.org/
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。


STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓

Facebook メルマガ登録にて定期的に最新情報を受け取れます。
パーキンソン病の病期分類には、
「ホーエン・ヤールの重症度分類(ヤール重症度)」と「Movement Disorder Society Unified Parkinson’s Disease Rating ScaleTM(MDS-UPDRS)」の2つの尺度が使用されます。また「修正版ホーエン・ヤールの重症度分類」ではステージ1.5と2.5が追加され、より詳細な評価が可能となっています。
患者が入院したとき、入院中の看護師や医師が患者を採点し病期を分類することは必ずしも必要でもありませんが、採点に精通していると便利ではあります。
ホーエン・ヤールの重症度分類(ヤール重症度)は、運動症状に基づいて確立された1から5の病期分類を使用します。
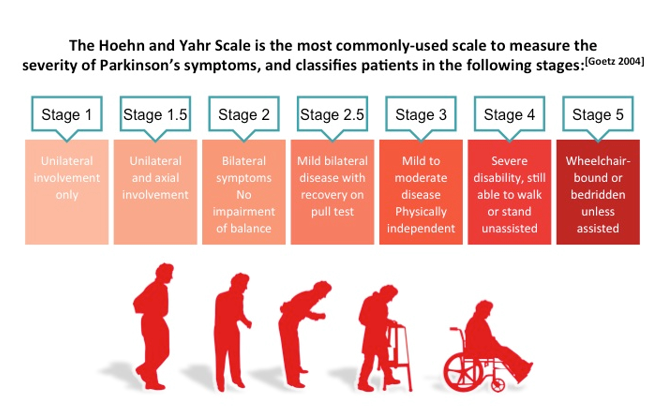
ステージ1:症状は非常に軽度です。体の片側だけに手足のふる えや筋肉のこわばりがみら れます。一般的に、パーキンソン病によってひどく影響を受けることはありません。
ステージ1.5:症状は軽度ですが、片側性の症状に加え、体幹の関与があります。
ステージ2:両側の手足のふるえや筋肉のこわばりなどがみられます。バランスは損なわれていません。生活がやや不便となります。この段階は早期のパーキンソン病と見なされます。薬への依存は、後期ほど顕著ではありません。
ステージ2.5:軽度の両側性症状と、後方へのバランス障害がみられますが、自力で立ち直ることができます。
ステージ3:軽度~中等度の両側性の障害を来します。バランスの問題、小刻み歩行、すくみ足がみられます。生活に支障は出ていますが、介助はまだ要しません。パーキンソン病の症状によって影響を受け始めており、投薬に依存していきます。
ステージ4:重度の障害を来し、杖・歩行器または車椅子が必要な場合があります。日常生活の様々な場面に援助を必要とします。
ステージ5:非常に衰弱し、車椅子またはベッドで寝たきりの状態です。
MDS-UPDRS
ホーエン・ヤールの重症度分類(ヤール重症度)は、パーキンソン病の症状がどのように進行しているかを説明するのに適した方法ですが、それ以外の疾患の側面については考慮されていません。
認知状態、主観的状態、日常生活活動、客観的な行動など、さまざまな側面を考慮に入れた、より包括的な評価尺度であるUPDRS(Unified Parkinson’s Disease Rating Scale)が開発されました。
1. Part I: 非運動症状の評価
Part IA: 評価者が実施し、認知機能や行動、気分などを評価します。
Part IB: 患者や介護者からの報告を基に、睡眠障害や自律神経症状などを評価します。
2. Part II: 日常生活動作(ADL)の評価
患者が日常生活で経験する運動症状の影響を自己評価します。
3. Part III: 運動機能の評価
医療従事者が患者の運動機能を直接評価します。
4. Part IV: 治療に関連する合併症の評価
薬物治療に伴う運動合併症やジスキネジアの有無とその影響を評価します。
といった4つのパート合計42の評価項目からなります。
各項目は0(正常)から4(重度)までのスコアで評価され、総合スコアが高いほど症状が重いことを示します。MDS-UPDRSは、オリジナルのUPDRSと比較して非運動症状の評価項目が増加し、より包括的な評価が可能となっています。スコアが高いほど、パーキンソン症状が患者に与える影響が大きいという判断となります。
運動症状の調査では、はい/いいえで質問に答えます。2007年にUPDRSを改訂したので、今日使用するバージョンはMDS-UPDRSと呼ばれます。MDS-UPDRSスケールは、患者が薬を服用したとき、または深部脳刺激装置の埋め込み術を受けた時などに症状が改善したかどうかを追跡することもできます。


近年の研究では、MDS-UPDRSの各部分における重症度レベルのカットオフ値が提案され、軽度、中等度、重度の分類に役立てられています。例えば、Part I(非運動症状)のスコア範囲は0~16点で、4点以下が軽度、5~8点が中等度、9点以上が重度と分類されます。同様に、Part II(ADL)は0~52点で、13点以下が軽度、14~26点が中等度、27点以上が重度とされています。これらのカットオフ値は、臨床現場での患者の状態把握や治療計画の策定に有用です。
さらに、MDS-UPDRSの信頼性と妥当性に関する研究も進められており、各項目の内的整合性が高いことが確認されています。これにより、症状の経時的な変化や治療効果の評価において、MDS-UPDRSが有効なツールであることが示されています。
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。


STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓

Facebook メルマガ登録にて定期的に最新情報を受け取れます。
パーキンソン病は、主に中脊黒質におけるドーパミン作動性神経細胞の損失を特徴とします。この病気には多様な前駆症状が含まれ、文字書能力の変化や小字症はそれらの中でも重要な要素です。その他のパーキンソン病における非運動症状の出現についてはこちらで詳しく解説しています。
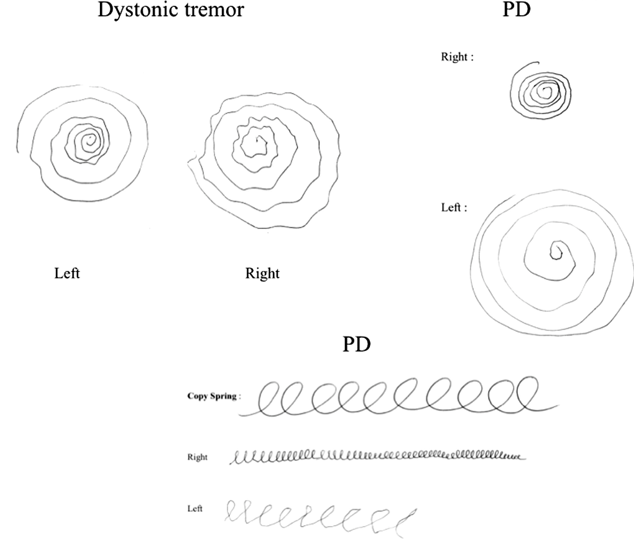
渦巻きを描く能力の低下は、PD患者における運動の開始や継続、調整の困難さを反映しています。これらの障害は以下のような病態に基づいています:
・運動開始の困難(無動・寡動): ドーパミン作動性ニューロンの減少により、基底核-皮質ループが障害され、意図的な運動の開始が遅れます。
・運動の滑らかさの低下: 筋固縮や運動のリズム性の喪失により、一定の速度で連続した動きを維持することが難しくなります。
・振戦: 静止時振戦が渦巻きの線を不規則にし、形を維持する能力を低下させます。
渦巻き描画テストの意義
渦巻きを描くタスクは、PD患者の運動制御能力を評価するための簡便な方法として臨床で使用されます。
・テスト方法: 被験者に白紙や指定された渦巻き模様をトレースするよう指示します。トレースの精度、速度、線の滑らかさを観察します。
・評価項目:
線のゆがみ:線がどれほど正確に渦巻きの形状を維持しているか。
速度のばらつき:描画中の速度が安定しているかどうか。
筆圧の変化:筆圧が不均一な場合、筋力制御や感覚フィードバックの問題を示唆します。
小字症とは、文字を書く際に文字が異常に小さくなる現象を指し、パーキンソン病患者の50-70%に認められると報告されています。この現象は、無動、筋固縮、さらには手の精密な運動制御の障害が主な原因とされています。ドーパミンが関与する基底核の機能不全により、意図的な運動の開始および計画が困難となり、これが小字症の特徴的な症状を引き起こす要因と考えられます。

診断方法
小字症の診断には、実際に書かれた文字を解析する方法が有効です。方法は以下の通りです。
・連続書字試験:特定の文字を連続して書かせ、その文字の大きさと縮小率を測定する。
・文章書字試験:短い文章を書かせ、各文字の大きさや行間、文字間隔を解析する。
・デジタルペンの使用:壁力センサーや加速度計を搭載したデジタルペンを使用することで、筆圧、書字速度、運動軌跡などの詳細なデータを収集する。
治療・リハビリテーション方法
小字症に対する治療は、薬物療法とリハビリテーションを組み合わせて行われます。
・薬物療法:レボドパやドーパミンアゴニストなどを投与することで、ドーパミン作動性神経伝達を補充し、運動症状の改善を図ります。ただし、小字症に対する効果には個人差が大きいとされています。
・書字訓練:マス目のある用紙を使用し、一定の大きさで文字を書く練習を行う。解析結果から視覧的フィードバックを生かした訓練が有効です。


参考文献
1.Quantitative Analysis of Bradykinesia and Rigidity in Parkinson’s Disease
https://pubmed.ncbi.nlm.nih.gov/29568281/
2.Digitized analysis of handwriting and drawing movements in healthy subjects: methods, results and perspectives
https://www.sciencedirect.com/science/article/abs/pii/S0165027099000801
3.Validity and reliability of a new tool to evaluate handwriting difficulties in Parkinson’s disease
https://pubmed.ncbi.nlm.nih.gov/28253374/
4.Neural correlates underlying micrographia in Parkinson’s disease
https://pubmed.ncbi.nlm.nih.gov/26525918/
5.Gender-related differences in the burden of non-motor symptoms in Parkinson’s disease
https://pubmed.ncbi.nlm.nih.gov/22237822/
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。


STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓

Facebook メルマガ登録にて定期的に最新情報を受け取れます。
パーキンソン病(PD)は、主に運動症状が注目される疾患ですが、進行に伴い神経精神病学的問題が出現することが知られています。これらの問題は運動症状に先行する場合もあり、患者の生活の質(QOL)に大きな影響を与えるため、早期発見と適切な管理が重要です。

無関心は、患者が日常活動への興味ややる気を失う症状です。うつ病と非常に類似していますが、無関心の場合は情緒的苦痛を伴わない点が特徴です。例えば、以前は楽しんでいた趣味や社会的交流への関心が薄れますが、悲しみや無力感は伴いません。この症状はドーパミン経路の異常と関連しており、パーキンソン病の進行とともに顕著になります。
診断と管理
・無関心を診断するには、Apathy Evaluation Scale(AES)やその他の心理測定ツールが有用です。
・治療としては、プラミペキソールやロピニロールなどのドパミン作動薬が一定の効果を示す場合があります。また、モダフィニルのような覚醒促進薬が有効であることも報告されています。
・患者とその家族に対して無関心が疾患の一部であることを説明し、理解を深めることが重要です。

思考速度の低下は、PDにおける最も一般的な認知障害の一つであり、患者が情報を処理する能力が遅くなることを指します。例えば、会話の中で適切な言葉が思い浮かばず、コミュニケーションが困難になることがあります。この障害は患者の社会生活や仕事に重大な影響を及ぼします。
具体例
・家族や友人との夕食会で、会話のペースについていけなくなり孤立感を感じる。
・重要な意思決定が必要な場面で、情報を迅速に処理できないため困難を経験する。
管理の戦略
・定期的な神経心理学的評価を通じて、認知機能の進行をモニタリングします。
・認知リハビリテーションを通じて、記憶力や注意力を向上させるトレーニングを実施します。
・環境調整を行い、患者がゆっくりと意思決定できるよう支援します。

パーキンソン病に関連する認知症(PDD)は、疾患の進行とともに発症し、高次脳機能の低下を引き起こします。主に新皮質が影響を受け、記憶、注意、言語能力、視空間認知などが障害されます。進行は緩徐ですが、患者の独立性を大きく損ないます。
症状
・新しい情報を覚えることが困難になる。
・日常のルーチンを維持するのが難しくなる。
・視空間の認知障害により、運転や調理が困難になる。
治療アプローチ
・コリンエステラーゼ阻害薬(リバスチグミン、ドネペジル)を使用し、認知機能の低下を遅らせる。
・ケアプランを作成し、患者と家族の負担を軽減します。
精神病(Psychosis)
精神病は、PD患者の50%が経験する症状であり、幻覚、妄想、さらには行動の変化を引き起こします。これらの症状は疾患自体に起因する場合もあれば、治療薬(特にドパミン作動薬)の副作用として発生する場合もあります。
主な症状
・幻覚:主に視覚的なもので、人物や物体が見える。
・妄想:家族が敵対的であると感じるなど、非現実的な信念。
治療
・クエチアピンやピマバンセリンなどの非定型抗精神病薬が有効です。
・症状の重篤度に応じて薬物治療を調整し、副作用を最小限に抑えます。

入院中のPD患者はせん妄を発症するリスクが高く、環境の変化や薬剤の影響が主な原因となります。せん妄は一過性ですが、適切に管理しない場合、患者の予後に悪影響を及ぼす可能性があります。
管理
・入院中の環境を整え、刺激を最小限に抑える。
・ベンゾジアゼピンの使用を避け、非薬物療法を優先します。

睡眠障害はPD患者に非常に一般的であり、日中の眠気や集中力の低下を引き起こします。代表的な症状として、REM行動異常(REMBD)、夜間頻尿、睡眠の断片化が挙げられます。
治療
・REMBDにはクロナゼパムが有効です。
・睡眠環境の改善を推奨します。部屋を暗くし、規則的な就寝スケジュールを守ることが重要です。

自律神経障害は、血圧調整、消化、発汗などの機能に影響を与えます。特に起立性低血圧は転倒リスクを高めるため、慎重な管理が必要です。
治療
・血圧低下を防ぐためにフルドロコルチゾンやミドドリンを使用します。
・食事の際に塩分を増やす、弾性ストッキングを使用するなどの非薬物療法を併用します。
消化管の問題
便秘や胃不全麻痺はPD患者で非常に一般的です。これらは薬物吸収に影響を与えるため、特に注意が必要です。
治療
・水分と食物繊維の摂取を増やし、下剤を必要に応じて使用します。
・胃不全麻痺には、プロキネティック薬(例:ドンペリドン)が推奨されます。
1.”Apathy in Parkinson’s Disease: Defining the Park Apathy Subtype” (2022).
https://pubmed.ncbi.nlm.nih.gov/35884730/
2.”Cognitive Impairment in Parkinson’s Disease: An Updated Overview Focusing on Emerging Pharmaceutical Treatment Approaches” (2023).
https://pubmed.ncbi.nlm.nih.gov/37893474/
3.”Parkinson’s Disease and Dementia with Lewy Bodies: One and the Same” (2024).
https://pubmed.ncbi.nlm.nih.gov/38640172/
4.”Sleep disturbances, cognitive decline, and AD biomarkers alterations in early Parkinson’s disease” (2024).
https://pubmed.ncbi.nlm.nih.gov/38764318/
5.”Unraveling Autonomic Dysfunction in GBA-Related Parkinson’s Disease” (2023).
https://pubmed.ncbi.nlm.nih.gov/38026514/
6.”Gastrointestinal dysmotility in rodent models of Parkinson’s disease” (2024).
https://pubmed.ncbi.nlm.nih.gov/38261717/
当施設は脳神経疾患や整形外科疾患に対するスペシャリストが皆様のお悩みを解決します。詳しくはHPメニューをご参照ください。

STROKE LAB代表の金子唯史が執筆、2024年に医学書院より発売された「脳の機能解剖とリハビリテーション」から以下の内容を元に具体的トレーニングを呈示します。


STROKE LABではお悩みに対してリハビリのサポートをさせていただきます。詳しくはHPメニューをご参照ください。

国家資格(作業療法士取得)
順天堂大学医学部附属順天堂医院10年勤務後,
御茶ノ水でリハビリ施設設立 7年目
YouTube2チャンネル登録計40000人越え
アマゾン理学療法1位単著「脳卒中の動作分析」他
「近代ボバース概念」「エビデンスに基づく脳卒中後の上肢と手のリハビリテーション」など3冊翻訳.
————————————————————
〒113-0033 文京区本郷2-8-1 寿山堂ビル3階
ニューロリハビリ研究所 STROKE LAB
電話番号:03-6887-5263
メールアドレス:t.kaneko@stroke-lab.com
TwitterやYouTubeなどはアイコンをクリック↓↓↓
Copyright c 2016 脳リハ.com Rights Reserved.